科研方向
Research
在贺建奎实验室,我们相信,真正值得投入一生去追问的科学问题,往往源自病床前最真实的痛苦。我们不只是"研究什么",更始终在问"为什么研究它",以及"这项研究能否让一个真实的人活得更久、更好"。我们选择的科研方向,可能是当今生物医学中最具挑战性的课题之一,也正因为它们背后关乎苦难的终结,我们必须一丝不苟。
一|人类胚胎基因编辑
我们为什么研究人类胚胎基因编辑?不是为了炫耀人类对生命的"掌控力",而是因为在一些极其严重的单基因遗传病中,唯一的治愈可能,存在于生命最初的那一刻。如果能在受精卵阶段精准修复错误的基因,或许就能避免孩子在出生后饱受病痛折磨,甚至夭折。
但我们更清楚:这是一把双刃剑,必须极端慎重。正因其可能改变的不仅是一条生命,而是一代人,甚至多个家族的遗传史,我们把安全性与伦理性作为先决条件。当前所有研究仅限于动物模型(小鼠、猴)和经伦理批准的人类弃用胚胎,目的为评估脱靶风险、嵌合率、长程效应与遗传稳定性等核心参数。
我们严肃承诺:在没有取得国家级伦理委员会与相关监管机构的批准前,我们不会开展任何与临床妊娠相关的基因编辑实验。技术可以发展,底线不能后退。我们研究这项技术,是为了让未来的"可能性"经得起道德的审视,而非制造轰动或争议。

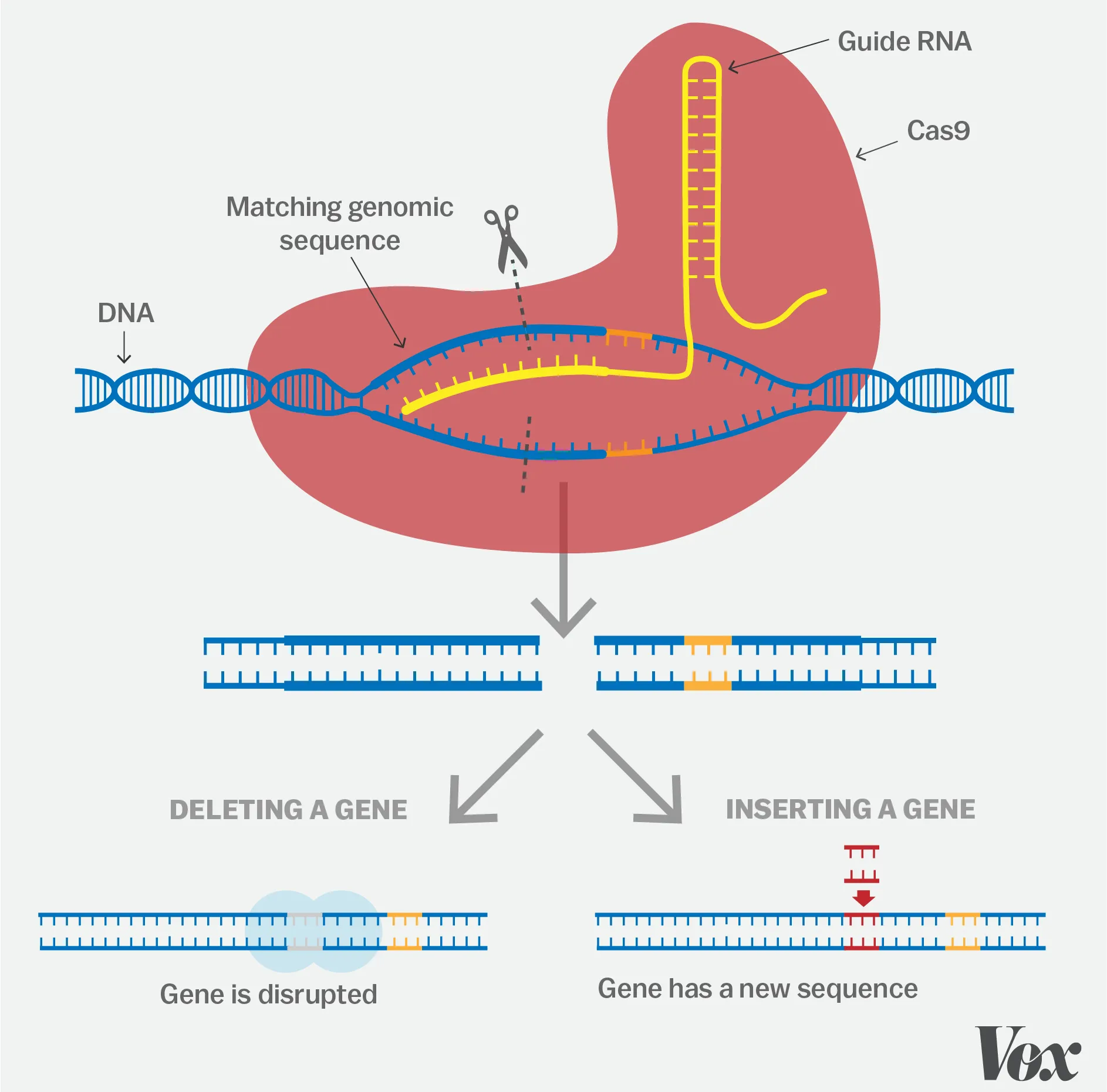
二|罕见病平价基因治疗
技术"能做到",和技术"被谁用得起",之间有着一整座山谷。
罕见病不等于不重要。在中国,每年新增罕见病患者数量庞大,但由于患病人数分散、疗法研发成本高昂、医保尚未普遍覆盖,绝大多数患者与家庭只能眼睁睁看着希望的疗法与自己无缘。欧美已上市的基因疗法,如治疗脊髓性肌萎缩症(SMA)的Zolgensma,单剂价格高达200万美元以上;治疗DMD的Elevidys,费用亦逾千万人民币。这不仅是医学问题,也是伦理困局。
我们的目标不是"复制现有药物",而是从源头做出改变:
- 用新一代CRISPR系统提高编辑效率,降低所需载体数量;
- 用更可控、更可规模化的递送系统(如优化AAV、非病毒递送);
- 用系统生物学与人工智能辅助疗效预测,提升前期筛选效率;
- 用更简单、更快速的GMP工艺设计,降低生产与质控成本;
- 通过创新支付机制与社会资助,让药物覆盖更多患者。
我们现已开展的项目包括:针对杜氏肌营养不良症(DMD)的micro-dystrophin基因载体构建与动物实验研究;针对特定代谢类罕见病的基因替代策略设计;以及多个合作医院支持下的临床前药效与毒理评估平台建设。
我们愿意花更长时间、走更复杂的路径,只为让希望落在更多真实的病人身上。


三|酶促DNA合成与信息存储技术
DNA,不仅是生物的语言,也可能成为数字信息存储的新载体。我们投身于酶促DNA合成技术的研发,并非出于未来主义的幻想,而是基于两个现实需求:一是从根本上降低生物实验的核心原料(DNA序列)的成本;二是为信息社会的"冷数据"存储提供一种几乎不受时间衰减的新介质。
传统化学合成DNA过程昂贵且精度受限,而酶促法(尤其是基于新型DNA聚合酶变体与模板辅助机制)有望突破千碱基合成极限,并实现高保真度与可控终止。
我们正在与国内外相关团队合作开发第三代合成仪样机,目标包括:
- 实现单链1000bp以上的准确合成;
- 控制误差率在万分之一以下;
- 通过磁珠/微流控模块实现并行反应;
- 实现对合成序列的实时监测与反馈控制;
- 建立DNA信息编码与读取格式的跨学科接口。
这项研究连接了生物学、信息工程、材料科学与逻辑编码,在微观尺度上推动科学边界,也为人类信息文明的长期保存打开新思路。


每一项科研的背后,都是对"为什么做"与"谁会受益"的深度凝视。
贺建奎实验室的科研,并非为名而来。我们愿意从复杂中寻找真实,在真实中反思责任,在责任中重新定义科研的温度。